Введение
Инсульт остается одной из ведущих причин инвалидизации и смертности населения во всем мире. В Российской Федерации ежегодно регистрируется около 450 000 случаев острого нарушения мозгового кровообращения, причем у 80–90% больных в остром периоде выявляется гемипарез различной степени выраженности. Постинсультная спастичность (ПС) представляет собой одно из наиболее частых и инвалидизирующих осложнений, развивающееся в 17–43% случаев, а по некоторым данным – до 65–80% всех пациентов, перенесших инсульт.
Спастичность в значительной степени снижает функциональную активность пациентов, препятствует проведению реабилитационных мероприятий, увеличивает нагрузку на ухаживающих лиц и существенно ухудшает качество жизни как самих больных, так и членов их семей. Затраты на медицинский уход за пациентами со спастичностью в четыре раза превышают расходы на лечение больных без данного осложнения. В связи с высокой медико-социальной значимостью проблемы изучение патогенеза спастичности и разработка эффективных подходов к её коррекции являются актуальными задачами современной неврологии и реабилитологии.
Определение и клинические проявления спастичности
Согласно классическому определению Lance (1980), спастичность представляет собой двигательное нарушение, являющееся частью синдрома поражения верхнего мотонейрона (СВМН), которое характеризуется скорость-зависимым повышением мышечного тонуса и сопровождается повышением сухожильных рефлексов в результате гипервозбудимости рецепторов растяжения. Спастичность в сочетании с парезом является одним из наиболее частых неврологических синдромов, развивающихся в результате поражения супраспинальных или спинальных нисходящих двигательных систем с обязательным вовлечением кортикоспинального тракта.
Клинически спастичность выявляется при исследовании пассивных движений в паретичной конечности как повышенное сопротивление (сокращение) мышцы при её быстром растяжении. Характерным признаком является феномен «складного ножа», когда при пассивном сгибании пораженной конечности выраженное в начале движения сопротивление мышцы внезапно сменяется её расслаблением в направлении производимого движения.
Спастичность чаще всего затрагивает сгибатели верхних конечностей (локтевой сустав, запястье, плечевой сустав, пальцы рук) и разгибатели нижних конечностей. Формируются характерные паттерны спастичности: для руки – приведенное и внутренне ротированное плечо, согнутый локоть, пронированное предплечье, согнутое запястье и сжатый кулак; для ноги – согнутое или приведенное бедро, негнущееся или согнутое колено, подошвенное сгибание стопы.
Развитие спастичности происходит не сразу после инсульта. В первые дни пребывания в стационаре у большинства пациентов наблюдается вялый парез со сниженным мышечным тонусом и слабостью в мышцах. Первые признаки спастичности специалист может заметить уже через 2–3 недели, однако клинически значимые проявления обычно формируются через несколько месяцев. Через 16 недель после инсульта спастичность встречается у 22–25% пациентов, причем почти в половине случаев это тяжелая форма.
Патогенез постинсультной спастичности
Патофизиологические механизмы развития спастичности сложны и многокомпонентны. С учетом современных достижений нейрофизиологии и нейрохимии спастичность рассматривается как результат нарушения взаимодействия различных супраспинальных и спинальных нейротрансмиттерных систем, связанного с центральным повреждением и последующими адаптивными изменениями всех структур, участвующих в генерации и регуляции движений.
Роль поражения нисходящих путей
В основе возникновения спастичности лежит снижение или утрата тормозных влияний супраспинальных отделов центральной нервной системы на спинальные двигательные и вставочные нейроны. Поражение нисходящих путей, идущих от верхнего мотонейрона, имеет ключевое значение в патогенезе спастичности, хотя роль конкретных участков мозга или путей до конца не изучена.
Важно отметить, что изолированное поражение пирамидного пути, как показано в экспериментальных исследованиях, не вызывает спастичность, а приводит лишь к парезу в дистальных отделах конечностей и утрате тонких движений руки. В случаях инсульта обычно возникает поражение не только пирамидного пути, но и других двигательных трактов, таких как кортико-ретикуло-спинальный тракт, что и сопровождается развитием спастичности.
Особую роль в формировании спастичности играют моноаминергические нисходящие пути, берущие начало от ядер ствола мозга, нейромедиаторами которых являются серотонин и норадреналин. Эти пути модулируют функцию мотонейронов и, воздействуя на соответствующие рецепторы, вызывают патологическое плато деполяризации, что клинически проявляется спастичностью и мышечными спазмами.
Спинальные механизмы
На спинальном сегментарном уровне развивается гиперактивность рефлекторных реакций, которая является непосредственным патофизиологическим механизмом спастичности. Потеря супраспинального тормозного контроля приводит к нарушению баланса между процессами возбуждения и торможения, развитию денервационной гиперчувствительности и нейронального спраутинга.
Происходит гипервозбудимость мотонейронов, меняются синаптические связи с денервированными интернейронами, нарушаются механизмы реципрокного торможения через вставочные клетки. Повышение рефлекторной возбудимости подтверждается усилением Н-рефлекса, представляющего рефлекторный ответ мышцы на раздражение чувствительных волокон. Развивается характерное скорость-зависимое повышение мышечного тонуса, повышение и иррадиация сухожильных рефлексов, флексорные спазмы.
Нейрохимические изменения
Установление ключевой роли в развитии спастичности повышения активности возбуждающих глутаматергических систем при одновременном снижении тормозных ГАМК-ергических влияний привело к разработке патогенетически обоснованных подходов к терапии. Медиаторный дисбаланс служит важным фактором развития и прогрессирования спастичности.
Периферические изменения
При длительном течении спастичности развиваются вторичные структурно-функциональные изменения скелетных мышц: формируются склеротические (рубцовые) изменения, происходит дегенерация нервных волокон, демиелинизация, что усугубляет клиническую картину. Без адекватной коррекции спастичность приводит к формированию контрактур, болевых синдромов, остеопороза, пролежней и тромбофлебитов.
Методы оценки спастичности
Клиническая оценка пациента с постинсультной спастичностью должна проводиться не только с целью выявления заинтересованных мышц, но также с учетом сопутствующего неврологического дефицита и влияния спастичности на повседневную жизнь пациента и его семьи.
Модифицированная шкала Ашфорта
Наиболее распространенным инструментом для оценки степени спастичности является Модифицированная шкала Ашфорта (Modified Ashworth Scale), предложенная в 1987 году. Шкала направлена на оценку силы сопротивления мышц к пассивному движению в суставе с переменной скоростью. Оценка проводится по 6-балльной шкале (0, 1, 1+, 2, 3, 4), где:
- 0 – мышечный тонус не повышен;
- 1 – незначительное повышение тонуса с «захватом» в конце амплитуды движения;
- 1+ – незначительное повышение тонуса с «захватом» без возврата к нормальному тонусу или сопротивлением до половины амплитуды движения;
- 2 – более выраженное повышение тонуса при более половине амплитуды движения, но пассивные движения не затруднены;
- 3 – значительное повышение тонуса, пассивные движения затруднены;
- 4 – ригидное сгибательное или разгибательное положение конечности без пассивной подвижности.
Дополнительные методы оценки
Для комплексной оценки функционального состояния используются также измерение амплитуды движений в суставе, характеристика моторных возможностей для каждой мышечной группы, оценка интенсивности болевого синдрома (визуальная аналоговая шкала), тестирование активной функции верхней конечности, шкалы инвалидизации и нагрузки на ухаживающих лиц.
Возможности коррекции постинсультной спастичности
Основная цель лечения постинсультной спастичности состоит в улучшении функциональных возможностей паретичных конечностей, уменьшении боли и дискомфорта, облегчении ухода за пациентом, предотвращении формирования контрактур. Ведение пациентов со спастичностью требует проведения комплекса мероприятий с применением медикаментозных и немедикаментозных методов.
- Физическая терапия и лечебная гимнастика
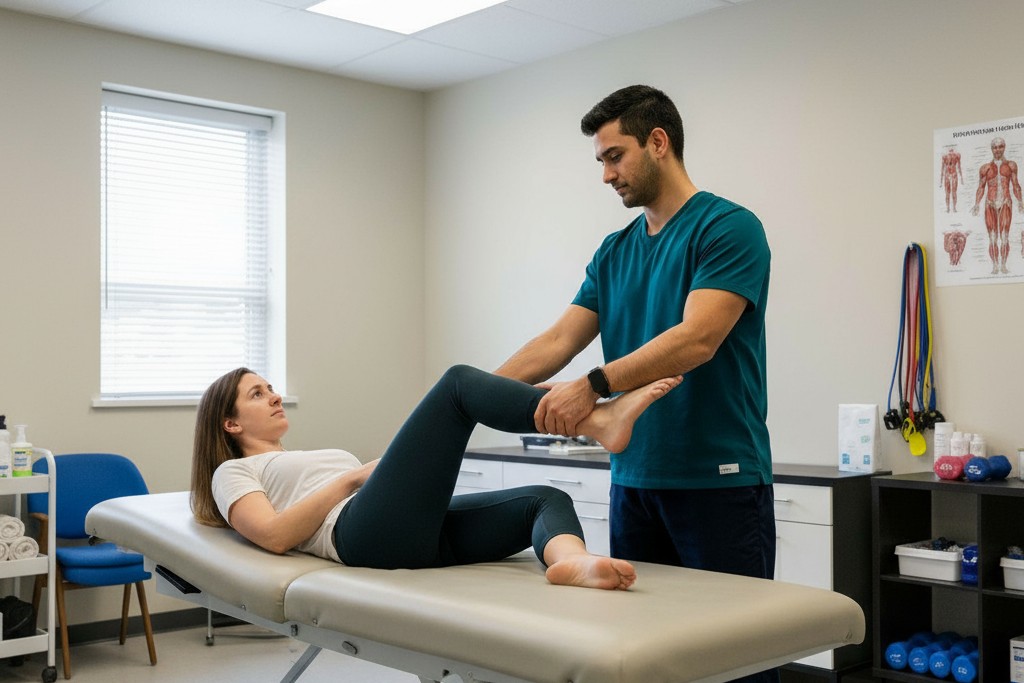
Лечебная гимнастика представляет наиболее эффективное и основное направление ведения пациентов с постинсультным спастическим гемипарезом. Физиотерапию следует начинать уже с первых дней после развития инсульта, она должна быть направлена на тренировку утраченных движений, самостоятельное стояние и ходьбу, а также профилактику развития контрактур в паретичных конечностях.
Кинезотерапия – адаптированная лечебная физкультура для постинсультной реабилитации – включает пассивные движения (выполняемые специалистом), активно-пассивные упражнения и активную гимнастику с постепенным увеличением нагрузки. Растяжка является наиболее часто используемой техникой для профилактики и лечения мышечных контрактур; специалисты рекомендуют короткие, но регулярные статические растяжки с интервалами 2,5–3 часа между сеансами.
Важнейшее значение имеет лечение положением и правильное позиционирование пациента с использованием специальных ортопедических изделий, коррегирующих укладок, подушек и валиков для предотвращения формирования патологических установок. Необходимо часто менять положение тела (не реже чем каждые два часа) для профилактики контрактур и пролежней.
- Массаж
Массаж проводится с самых первых дней после инсульта для нормализации мышечного тонуса, улучшения кровообращения и лимфооттока, уменьшения боли и отечности. Применяются различные техники: классический лечебный массаж, сегментарно-рефлекторный, точечный, соединительнотканный. Для мышц со спастичностью используются мягкие, расслабляющие приемы, в то время как для паретичных мышц-антагонистов применяется более интенсивное воздействие с преобладанием разминания.
- Физиотерапевтические методы
Физиотерапия при спастичности включает различные методы электростимуляции, тепловые процедуры, магнитотерапию. Функциональная электростимуляция (ФЭС) является эффективным методом, позволяющим снизить патологический тонус спастичных мышц, активизировать паретичные мышцы-антагонисты, восстановить рефлекс реципрокного торможения и выработать правильный двигательный стереотип.
Начинать лечение спастичности с применением ФЭС следует как можно раньше, до развития структурно-функциональных изменений скелетных мышц. Используются различные режимы: релакс-стимуляция для снижения тонуса спастичных мышц, тонизирующая стимуляция для активации атрофичных мышц, супрачастотная стимуляция для уменьшения спастики крупных мышц перед ЛФК.
- Медикаментозная терапия
К миорелаксантам центрального действия, наиболее часто используемым для лечения спастического мышечного гипертонуса, относятся баклофен, тизанидин (Сирдалуд), толперизон (Мидокалм) и диазепам.
• Баклофен представляет аналог ГАМК, который связывается с пресинаптическими ГАМК-В-рецепторами, приводя к уменьшению выделения возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне. Начальная доза составляет 10–15 мг/сут с постепенным увеличением до средней терапевтической дозы 30–60 мг/сут. При выраженной генерализованной спастичности возможно интратекальное введение баклофена с использованием имплантируемой помпы.
• Тизанидин (Сирдалуд) – агонист α2-адренорецепторов, действует на большее число нейрофизиологических механизмов, участвующих в формировании спастичности. Антиспастический эффект тизанидина сопоставим с эффектом баклофена, однако при адекватном подборе дозировки он лучше переносится, не вызывает общей мышечной слабости и не усиливает слабость в парализованной конечности.
• Толперизон (Мидокалм) снижает активность спинальных нейронов путем ограничения потока натрия через мембрану нервных клеток. Препарат не оказывает седативного эффекта, имеет благоприятный спектр переносимости и является препаратом выбора для амбулаторного лечения и терапии пожилых пациентов.
Для уменьшения побочных эффектов возможно комбинированное лечение с использованием двух или трёх препаратов в сниженных дозах.
- Ботулинотерапия
Ботулинотерапия является современным, высокоэффективным и безопасным методом лечения фокальной и мультифокальной спастичности. Ботулинический токсин типа А (БоНТ-А) действует, блокируя высвобождение ацетилхолина в нервно-мышечном синапсе, что приводит к расслаблению спастичной мышцы.
Процедура проводится под контролем ультразвука для точного введения препарата в мышцы-мишени. Эффект развивается через 10–14 дней после введения и достигает пика через 2–4 недели, сохраняясь в течение 3–6 месяцев. Ботулинотерапия показана пациентам со спастичностью два и более балла по шкале Ашфорта и входит в большинство международных клинических рекомендаций по лечению последствий инсульта.
Важно подчеркнуть, что медикаментозная терапия во всех случаях должна сочетаться с физиотерапией, составляющей основу реабилитации пациентов со спастичностью. Ботулинотерапия создает «окно возможностей» для более эффективного проведения лечебной гимнастики и кинезотерапии, позволяя выявить остаточную произвольную активность, скрытую повышенным тонусом мышц.
Факторы прогноза и сроки реабилитации
Возможности восстановления во многом определяются сроками с момента заболевания, степенью пареза и наличием когнитивных расстройств. Чем меньше сроки с момента инсульта, тем более вероятно улучшение от лечения спастичности, так как оно может привести к существенному улучшению двигательных функций в период максимальной пластичности центральной нервной системы.
Восстановление движений происходит преимущественно в первые 3–6 месяцев после инсульта, пик восстановления приходится на первые 2–3 месяца. Это так называемый сенситивный период, когда процессы пластичности в несколько раз более активны и реабилитация может быть наиболее эффективной. Однако восстановление сложных бытовых и трудовых навыков может продолжаться до года и более.
Предикторами развития спастичности являются низкие баллы по шкалам Бартеля, локализация очага поражения, изначальная глубина пареза, наличие чувствительных нарушений на стороне паралича и мозжечковых симптомов.
Заключение
Постинсультная спастичность представляет собой сложный многокомпонентный синдром, развивающийся у значительной части пациентов, перенесших инсульт, и существенно снижающий качество их жизни. Патогенез спастичности связан с поражением супраспинальных нисходящих путей, нарушением баланса между процессами возбуждения и торможения на спинальном уровне, изменениями нейромедиаторных систем и вторичными структурными изменениями в мышцах.
Современные подходы к коррекции постинсультной спастичности основаны на комплексном применении медикаментозных и немедикаментозных методов. Ключевую роль играет ранняя активизация пациентов и регулярное проведение лечебной гимнастики и кинезотерапии. Физиотерапия, массаж и функциональная электростимуляция составляют основу реабилитационных программ. При недостаточной эффективности немедикаментозных методов показано назначение миорелаксантов центрального действия, а при фокальной и мультифокальной спастичности высокоэффективна ботулинотерапия.
Успех реабилитации во многом зависит от раннего начала лечения, индивидуального подбора методов коррекции с учетом выраженности спастичности, паттернов её распределения и функциональных целей пациента. Мультидисциплинарный подход с участием невролога, реабилитолога, физического терапевта, массажиста и других специалистов позволяет достичь максимального восстановления двигательных функций и повышения качества жизни пациентов с постинсультной спастичностью.
Список использованной литературы
- Выбор фармакологической терапии при спастическом мышечном гипертонусе // Лечащий врач. 2013. № 2. С. 94–99.
- Гетерогенность патофизиологических механизмов развития синдрома спастичности // Фарматека. 2020. № 2. С. 78–86.
- Епифанов В.А. Медико-социальная реабилитация больных после инсульта. М.: МЕДпресс-информ, 2006. 352 с.
- Катунина Е.А. Патогенетические аспекты и подходы к терапии спастичности // Клиническая фармакология и терапия. 2021. № 3. С. 24–32.
- Катушкина Э.А. Механизмы патогенеза постинсультной спастичности // Нервно-мышечные болезни. 2011. № 2. С. 23–29.
- Контрактуры после инсульта: профилактика и лечение // Центр реабилитации «Три сестры». 2025. URL: https://three-sisters.ru/blog/kontraktury-posle-insulta(дата обращения: 12.01.2026).
- Оценка спастики. Модифицированная шкала Ашворса // Клиника Козявкина. 2020. URL: https://kozyavkin.com/ru/news/novosti/news/ocenka-spastiki-modificirovannaja-shkala-ashvorsa/(дата обращения: 12.01.2026).
- Постинсультная спастичность и ее лечение // РМЖ. 2016. № 8. С. 524–530.
- Постинсультные двигательные и когнитивные нарушения // Журнал неврологии и психиатрии им. С.С. Корсакова. 2020. Т. 120. № 11. С. 99–106.
- Реабилитация после инсульта: кинезотерапия // Пансион «Наша Забота». 2022. URL: https://nzabota.ru/poleznaya-informaciya_page?id=92(дата обращения: 12.01.2026).
- Реабилитация пациентов после ОНМК // Клиника «Волынка». 2023. URL: https://volynka.ru/Articles/Text/2929(дата обращения: 12.01.2026).
- Роль миорелаксантов в лечении спастичности // РМЖ. 2016. № 8. С. 510–515.
- Спастика после инсульта: электростимуляция «МИСТ» // НейроТех. 2017. URL: https://neurotech.ru/materials/(дата обращения: 12.01.2026).
- Спастичность после инсульта // РМЖ. 2005. № 13. С. 862–866.
- Спастичность после инсульта // Центр реабилитации «Три сестры». 2025. URL: https://three-sisters.ru/blog/spastika-posle-insulta(дата обращения: 12.01.2026).
- Спастичность: патогенез и современные подходы к лечению // РМЖ. 2016. № 8. С. 502–508.
- Толмачева В.А. Постинсультная спастичность, индивидуализированный подход к лечению // Нервно-мышечные болезни. 2016. № 4. С. 39–46.
- Функциональная электростимуляция при спастичности // WalkAide Russia. 2016. URL: https://walkaide.ru/reabilitaciya/(дата обращения: 12.01.2026).
- Хасанова Д.Р. Постинсультная спастичность // Практическая медицина. 2016. № 2 (94). С. 17–23.
- Lance J.W. The control of muscle tone, reflexes, and movement: Robert Wartenberg Lecture // Neurology. Vol. 30. P. 1303–1313.